Akkumulátor működése I.
A savas-ólom akkumulátorok működése
Akkumulátor mint villamos energia tároló avagy mi zajlik le benne...
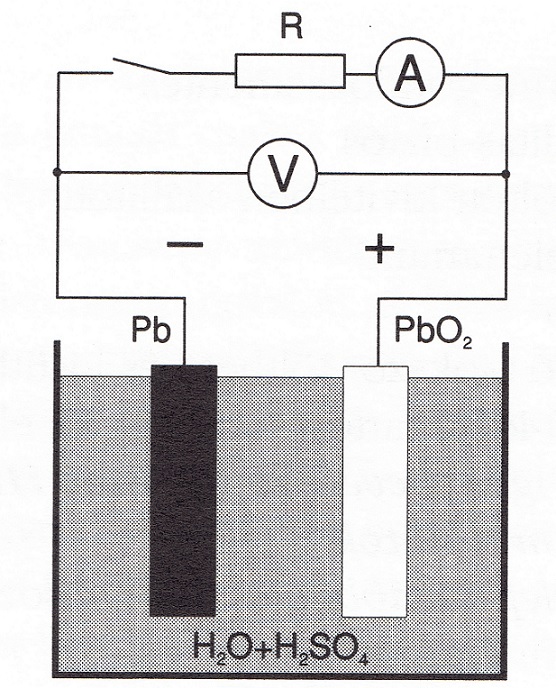
Ha egy kénsav vizes oldatával telt üvegedénybe egy ólomból(Pb) és egy ólomdioxidból(PbO2) készült elektróda párt helyezünk és a két lemez közé feszültség mérőt kötünk feszültséget mérhetünk. Ha azt egyszerű áramkört tovább fejlesztjük, példaképpen egy fogyasztót és egy kapcsolót közbe iktatunk a feszültségen kivűl villamos áramot is meg figyelhetünk.
A fenti áramkört az alábbi ábra illusztrálja.
+
Az ólomlemezen lejátszódó elektrokémiai folyamat
Az ólomlemezek oldatba merülésekor kémiai folyamat indul meg mivel az ólom affinitási sorban a hidrogén előtt áll.
Azt viszont fontos tudnunk hogy az elektrolitban a kénsav ionos állapotban van jelen hiszen disszociál-azaz ionjaira esik szét- az alábbi képlet szerint.
H2SO4 → 2H++SO42-
Az ólom ólomszulfáttá alakulásakor azonban szulfát ionos állapota miatt egy ólomszulfát létrejöttekor a lemezen 2 "többlet" -elektron keletkezik. A folyamat az elektrolitba merülésekor azonnal megkezdődik az áramkör megszakításakor az intenzitása lecsökken, majd gyakorlatilag megáll.
Az ólomdioxid lemezen lejátszódó elektrokémiai folyamat
Az ólomdioxid lemez oldatban merülésekor hasonlóképpen. mint az ólom lemeznél a kémiai folyamat megindul.
A kémiai folyamat eredményeképpen a lemezen ólomszulfát keletkezik , illetve ólomdioxid oxigénje az elektrolit hidrogénjével vízzé egyesül.
PbO2+SO42-+4H+→PbSO4-2e-+2H2O
Zárt áramkör esetén a folyamat itt is azonnal megkezdődik illetve az áramkör megszakításakor lefékeződik, majd teljesen megáll.
A reakció magyarázata hogy az elektrolithoz képest kb. +1,69V potenciálra feltöltődött lemez körül villamos erőtér megakadályozza a pozitív töltésű hidrogén atomok kilépését. Tehát kijelenthetjük hogy terhelésmentes ólomlemez megközelítőleg az elektrolithoz képest -0,35V az ólomoxid lemez kb. 1,69V potenciálra került , közöttük kb. 2V feszültséget mérhetünk. A nyugalmi feszültség értékét jelentősen befolyásolja az elekrolit összetétele savsűrűsége.
A nyugalmi feszültség = 0,84 + savsűrűség (kg/dm3 kifejezve)
Az áramkör zárásakor elektron áramlás indul meg a tiszta ólomlemez felől a fogyasztón keresztül az ólomdioxid lemez irányába. Ezt nevezzük, a valóságos áram iránynak ellenben a technikai áramirányt ezzel ellentétesen jelöljük. A töltéskiegyenlítődés hatására a lemez potenciálja csökken. A negatív lemezen az ólom folyamatosan ólomszulfáttá alakul ,amely mintegy pótolja a felhalmozott elektontöbblet-csökkenést. A pozitív lemezen az ólomdioxid is ólomszulfáttá alakul át , de itt az elektronhiány pótlódik. A folyamat közben az elektrolit folyamatosan hígul, hiszen a szulfátionok oxigénre cserélődnek, azaz víz keletkezik.
Az ólomakkumulátorokban kisütéskor lejátszódó elektrokémiai reakciót az alábbi egyenlettel írhatjuk fel.
-lemez elektrolit +lemez -lemez elektrolit +lemez
Kisütés
Pb + 2H2SO4 + PbO2 → PbSO4 + 2H2O + PbSO4
A fenti reakció (kisütés) intenzitása attól függ hogy mekkora a terhelés, mindaddig tart míg meg nem szakítjuk az áramkört , illetve el nem fogy valami a folyamatban részt vevő anyagok közül.
Az akkumulátorokról tudjuk, hogy elektromosan tölthetőek , tehát a terhelő árammal ellentétes irányú villamos áram hatására elektrolitikusan visszaalakítják a reakciótermékből az eredeti hatóanyagot.
A töltőáram hatására az ólomszulfát a negatív lemezen színólommá, a pozitívon pedig ólomdioxiddá alakul, és az elektrolit egyre sűrűbb lesz hiszen szulfátionok lépnek be az elektrolitba.
A töltéskor lejátszódó reakciót az alábbi képlettel lehet felírni.
-lemez elektrolit +lemez -lemez elektrolit +lemez
Töltés
PbSO4 + 2H2O + PbSO4 → Pb + 2H2SO4 + PbO2
Ha hasznosnak érzed az információt , oszd meg az ismerőseid között, csak egy kattintás...
